история
В 1780 году, Гальвани обнаружил , что , когда два различных металла (например, меди и цинка) находятся в контакте , а затем и в то же время в двух разных частях мышцы лягушки ноги, чтобы замкнуть цепь, контракты ног лягушки. Он назвал это « животное электричество ». Нога лягушки, а также как детектор электрического тока, была также электролит (использовать язык современной химии).
Через год после того, как Гальвани опубликовал свою работу (1790), Алессандро Вольта показал , что лягушки не было необходимости, а не с использованием детектора силы на основе и рассола пропитанной бумаги ( в качестве электролита). (Ранее Вольта был создан закон емкости C = QV с детекторами на основе силы). В 1799 году Вольта изобрел гальваническую груду, которая представляет собой кучу гальванических элементов каждый из которых состоит из металлического диска, слой электролита, а также диска другого металла. Он построил его полностью из небиологических материалов , чтобы бросить вызов Гальвани (а позже экспериментатора Леопольдо Nobili теории электричества животных) ‘s в пользу своего металл-металл теории контактного электричества. Маттеуччи в свою очередь построили батарею полностью из биологического материала в ответ на Вольта. Вид контакта электроэнергии Вольта характеризуется каждый электрод с номером , который мы теперь называем функцию работы электрода. Эта точка зрения игнорировала химические реакции на границах раздела электрод-электролит, которые включают в себя H 2 образование на более благородного металла в куче Вольта.
Хотя Вольта не понять работу батареи или гальванического элемента, эти открытия проложили путь для электрических батарей; Ячейки Вольта был назван IEEE Milestone в 1999 году.
Около сорока лет спустя, Фарадей (см законы Фарадея электролиза ) показал , что гальванический элемент — теперь часто называют вольтовой клетки — был химический характер. Фарадей ввел новую терминологию на язык химии: электрод ( катод и анод ), электролит и ион ( катион и анион ). Таким образом , Гальвани ошибочно думали источник электроэнергии (или источника эдс, или нахождения эдс) была в животном, Вольта ошибочно думали , что это было в физических свойствах изолированных электродов, но Фарадей правильно определил источник эдс в качестве химических реакций на двух интерфейсов электрод-электролит. Авторитетная работа по интеллектуальной истории гальванического элемента остается то , что Оствальд.
Было предложено Вильгельм Кениг в 1940 году , что объект известный как аккумулятор багдадского может представлять технологию гальванического элемента от древней Парфии . Реплики заполненные с лимонной кислотой или виноградного сока , как было показано , чтобы произвести напряжение. Однако, это далеко не уверено , что это его цель, других ученые отмечают, что он очень похож на суды, которые были использованы для хранения пергаментных свитков.
Cell напряжение
Напряжения (электродвижущая сила Е о ) получают путем гальванического элемента может быть оценена из стандартного Гиббса изменение свободной энергии в электрохимической реакции в соответствии с
ЕсеLLознак равно-Δрго(νеF){\ Displaystyle Е- {клеток} ^ {о} = — \ Delta _ {г} G ^ {о} / (\ пи _ {е} F)}
где ν е есть число электронов , переносимых в сбалансированных полуреакциях, и F является постоянная Фарадеем . Тем не менее, оно может быть определено более удобно в использовании стандартного потенциального стола для двух половины клеток , участвующих. Первый шаг заключается в определении двух металлов и их ионы , реагирующие в клетке. Тогда один смотрит вверх стандартный электродный потенциал ,
E O , в вольтах , для каждого из двух полуреакций . Стандартный потенциал ячейки равен более положительной E O значения минус более отрицательной E O значение.
Например, на рисунке выше решений являются CuSO 4 и ZnSO 4 . Каждое решение имеет соответствующую металлическую полосу в нем, и солевой мостик или пористый диск , соединяющий два решения , и позволяя SO 2- 4 ионов свободно протекать между медью и цинком решениями. Для того, чтобы вычислить стандартный потенциал один смотрит вверх медь и цинк половина реакции и считает , что :
- Cu 2+ + 2е -⇌ Си Е о = 0,34 В
- Zn 2+ + 2е -⇌ Zn , Е о = -0,76 В
Таким образом, общая реакция:
- Cu 2+ + Zn ⇌ Cu + Zn 2+
Стандартный потенциал для реакции тогда +0.34 V — (-0,76 В) = 1.10 В. Полярность клетки определяется следующим образом . Цинк металл сильнее , чем сокращение металлической меди , поскольку стандарт (сокращение) потенциал для цинка является более отрицательным , чем у меди. Таким образом, металлический цинк будет терять электроны ионов меди и развивать положительный электрический заряд. Константа равновесия , К , для ячейки задается
- перКзнак равноνеFЕсеLLорT{\ Displaystyle \ пер K = {\ гидроразрыва {\ Nu _ {е} FE_ {клетка} ^ {о}} {RT}}}
где Р является постоянной Фарадея , R является газовым постоянным и Т температура в градусах Кельвина . Для ячейки Даниеля К приблизительно равна 1,5 × 10 37 . Таким образом, в равновесии, несколько электронов переданы, достаточно , чтобы вызвать электроды должны быть заряжены.
Фактические Полуэлементы потенциалы должны быть вычислены с помощью уравнения Нернста как растворенные вряд ли будут в их стандартных состояниях,
- ЕПолуэлементзнак равноЕо-рTνеFпереQ{\ Displaystyle E _ {\ текст {Полуэлемент}} = E ^ {о} — {\ гидроразрыва {RT} {\ Nu _ {е} F}} \ пер _ {е} Q}
где Q представляет собой реакцию фактор . Когда заряды ионов в реакции равны, это упрощает для
- ЕПолуэлементзнак равноЕо-2,303рTνеFжурнал10{MN+}{\ Displaystyle E _ {\ текст {Полуэлемент}} = E ^ {о} -2,303 {\ гидроразрыва {RT} {\ Nu _ {е} F}} \ войти _ {10} \ влево \ {{\ текст {M}} ^ {п +} \ право \}}
где {М п + } является активность иона металла в растворе. В практике концентрации в моль / л, используется вместо активности. Металлический электрод находится в нормальном состоянии , так по определению имеет единичную активность. Потенциал всей клетки получают как разность между потенциалами для двух половин-клеток, так что это зависит от концентраций обоих растворенных ионов металла. Если концентрации являются одинаковыми, и уравнение Нернста не требуется при условиях , принятых здесь.
ЕсеLLзнак равноЕсеLLо{\ Displaystyle Е- {клеток} = Е- {клетка} ^ {о}}
Значение 2.303 RF является 1,9845 × 10 -4 В / К , так что при 25 ° С (298,15 К) потенциал Полуэлемент изменится только 0,05918 В / ν е , если концентрация иона металла увеличивается или уменьшилась в 10 раз .
- ЕПолуэлементзнак равноЕо-0,05918 Вνежурнал10MN+{\ Displaystyle E _ {\ текст {Полуэлемент}} = E ^ {о} — {\ гидроразрыва {0,05918 \ {\ текст {V}}} {\ Nu _ {е}}} \ лог _ {10} \ влево }
Эти расчеты основаны на предположении , что все химические реакции находятся в равновесии. Когда ток течет в цепи, условие равновесия не достигается , и напряжение элемента, как правило , быть уменьшено с помощью различных механизмов, таких как развитие перенапряжений . Кроме того , поскольку происходят химические реакции , когда клетка выработки энергии, концентрация электролита изменяется , и напряжение элемента уменьшается. Следствием температурной зависимости стандартных потенциалов является то , что напряжение получают путем гальванического элемента также зависит от температуры.
Схема гальванического элемента
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
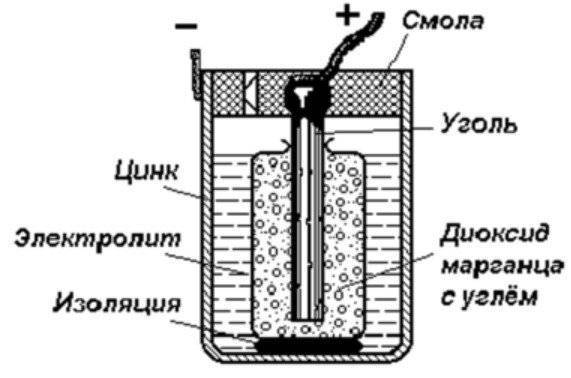
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование. Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.

Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется. Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания. Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки. В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось. И опять на машине проскочила искра.
Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия. Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала. В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов. К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Классификация гальванических элементов
Использованные источники питания различных типов и размеров
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля—Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Литий-ионный аккумулятор сотового телефона
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца (II) — PbSO4.
Также существуют щелочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия (K-OH).
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются. Восстановителем является водород (H2), метанол (CH3OH), метан (CH4); в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый.
В кислородно-водородном топливном элементе с щелочным электролитом, происходит превращение химической энергии в электрическую.
Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Таким образом изготавливается самодельный гальванический элемент.
Половина реакции и конвенции
Половина ячейка содержит металл в двух состояниях окисления . Внутри изолированный полуэлемент, есть окислительно-восстановительный (окислительно — восстановительная) реакция , которая находится в химическом равновесии , условие записывается символический следующим образом (здесь, «М» представляет собой катион металла, атом , который имеет заряд дисбаланс из — за потеря « п » электронов):
- М н + (окисленный видов) + п е — ⇌ М (уменьшенные виды)
Гальванический элемент состоит из двух половин клеток, таким образом, что электрод из одного полуэлемента состоят из металла А, а электрод другого полуэлемента состоит из металла B; окислительно-восстановительные реакции для двух отдельных половинок-клеток, таким образом:
- П + + п е — ⇌
- В м + + м е — ⇌ B
Целом сбалансированная реакция
- м А + п В т + ⇌ п В + м п +
Другими слова, атомы металла одной половины клетки окисляются в то время как металлические катионы другого полуэлемента уменьшаются. Путем разделения металлов в двух половин клеток, их реакция может управляться таким образом , что передачи сил электронов через внешнюю цепь , где они могут сделать полезную работу .
Электроды соединены с металлической проволокой для того , чтобы проводить электроны , которые участвуют в реакции.
- В одной половине клетки, растворенные катионы металла-B в сочетании с свободными электронами, которые доступны на границе раздела между раствором и металлическим электродом-B; эти катионы , таким образом , нейтрализует, заставляя их осаждения из раствора в виде отложений на металл-B электроде, процесс , известный как металлизация .
- Эта реакция восстановления приводит к тому, свободные электроны в металле-B электрода, проволоки, и металл-электрод, чтобы быть втянут в металл-B электрода. Следовательно, электроны боролись от некоторых из атомов металла электрода-A, как если бы катионы металла-B реагируют непосредственно с ними; те атомы металла-A стали катионы, которые растворяются в окружающем растворе.
- Поскольку эта реакция продолжается, Полуэлемент с металл-A электрода развивается положительно заряженный раствор (потому, что катионы металла-A растворяются в ней), в то время как другая половина-клеток развивается отрицательно заряженный раствор (потому что катионы металла-B выпадает в осадок из него, оставляя за собой анионы); неустанный, этот дисбаланс заряда остановит реакцию. Растворы половин клеток соединены солевого мостика или пористой пластины, что позволяет ионы переходить от одного решения к другому, который уравновешивает заряды решений и позволяет реакции, чтобы продолжить.
По определению:
- Анод представляет собой электрод , в котором окисление (потеря электронов) имеет место (металлический электрод-A); в гальваническом элементе, это отрицательный электрод, потому что , когда происходит окисление, электроны остались на электроде. Эти электроны затем проходят через внешнюю цепь катода к положительному электроду () ( в то время как при электролизе, электрический ток привода поток электронов в обратном направлении , а анод положительный электрод).
- Катодом является электрод , где уменьшение (прирост электронов) имеет место (металл-B электрод); в гальваническом элементе, то положительный электрод, а ионы получить снижаются, принимая электроны от электрода и пластин из ( в то время как при электролизе, катод представляет собой отрицательный полюс и привлекает положительные ион из раствора). В обоих случаях оператор « кот hode привлекает кошек ионов» истинно.
Гальванические, по своей природе, производят постоянный ток . Клетка Уэстон имеет анод , состоящий из кадмия , ртути амальгамы , и катод , состоящий из чистой ртути. Электролит представляет собой (насыщенный) раствор сульфата кадмия . Деполяризатор представляет собой пасту из сульфата ртути. Когда раствор электролита насыщается, напряжение ячейки очень воспроизводимым; следовательно, в 1911 году он был принят в качестве международного стандарта для напряжения.
Батарея представляет собой набор гальванических элементов, которые соединены вместе , чтобы сформировать единый источник напряжения. Например, типичный 12В свинцово-кислотный аккумулятор имеет шесть гальванических элементов , соединенных последовательно с анодами , состоящими из свинца и катодов , состоящих из диоксида свинца, и погружают в серной кислоте. Большие номера батареи , например в телефонной станции , обеспечивающей центральный офис питание телефонов пользователя, могут иметь клетки , соединенные как последовательно и параллельно.
Основное описание
Схема Zn-Cu гальванического элемента
В своей простейшей форме Полуэлемент состоит из твердого металла ( так называемое электродом ), которая погружена в раствор; раствор содержит катионы (+) электродного металла и анионов (-) , чтобы сбалансировать заряд катионов. Полный элемент состоит из двух половин-клеток, как правило , соединенных между собой полупроницаемую мембрану , или с помощью солевого мостика , который предотвращает ионы более благородного металла из покрытия на другом электроде.
Конкретный пример является клеточная Дэнилл (смотри рисунок), с цинком (Zn) , наполовину ячейка , содержащая раствор ZnSO 4 (сульфат цинка) и меди (Cu) полуэлемента , содержащую раствор CuSO 4 (сульфат меди) , Соль мост используется здесь , чтобы завершить электрическую цепь.
Если внешний электрический проводник соединяет медь и цинк электродов, цинк из цинкового электрода растворяется в раствор в виде Zn 2+ ионов (окисление), высвобождая электроны , которые входят внешний проводник. Для того, чтобы компенсировать увеличение концентрации ионов цинка, с помощью солевого мостика ионов цинка оставить и анионы ввести цинк Полуэлемент. В меди пол-ячейке, ионы меди пластины на медном электрод (уменьшение), принимая электроны , которые оставляют внешний проводник. Так как Cu 2+ ионы (катионы) пластины на медном электрод, последний называют катодом. Соответственно цинковый электрод является анодом. Электрохимическая реакция:
- Zn + Cu 2+ → Zn 2+ + Cu
Кроме того, поток электронов через внешний проводник, который является основным применением гальванического элемента.
Как обсуждались под , э.д.с. ячейки представляет собой разность Полуэлемента потенциалов, мера относительной легкости растворения двух электродов в электролит. Эдс зависит от обоих электродов и электролита, индикацию того, что эдс химическое вещество в природе.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Общая информация
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
-
Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Характеристики гальванических элементов
Гальванические элементы характеризуются электродвижущей силой (ЭДС), ёмкостью; энергией, которую он может отдать во внешнюю цепь; сохраняемостью.
- Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями протекающих электрохимических процессов в виде уравнения Нернста.
- Электрическая ёмкость элемента — это количество электричества, которое источник тока отдаёт при разряде. Ёмкость зависит от массы реагентов, запасённых в источнике, и степени их превращения; снижается с понижением температуры или увеличением разрядного тока.
- Энергия гальванического элемента численно равна произведению его ёмкости на напряжение. С увеличением количества вещества реагентов в элементе и до определённого предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
- Сохраняемость — это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохраняемость элемента уменьшается с ростом температуры хранения.
История изучения гальванических процессов
Луиджи Гальвани
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом, профессором медицины Болонского университета (г. Болонья, Италия) — Луиджи Гальвани в году: Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закреплённых на медных крючках, при прикосновении стального скальпеля. Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Итальянский физик и химик Алессандро Вольта, заинтересовавшись опытами Гальвани, увидел совершенно новое явление — создание потока электрических зарядов. Проверяя точку зрения Гальвани, А. Вольта проделал серию опытов и пришёл к выводу, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. В подтверждение — А. Вольта заменил лапку лягушки изобретённым им электрометром и повторил все действия.
В 1800 году А. Вольта впервые публично заявляет о своих открытиях на заседании Лондонского королевского общества, что проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления.
В 1802 году русский физик Василий Владимирович Петров сконструировал самую большую в мире гальваническую батарею, состоявшую из 4200 медных и цинковых кружков диаметром около 35 миллиметров и толщиной около 2,5 миллиметра, между которыми были размещены бумажные, пропитанные раствором нашатыря. Именно Петровым впервые была применена изоляция (с помощью сургуча). Вся конструкция была помещена в ящик из твердой древесины красного дерева, покрытый изолирующим слоем из различных смол. По современным оценкам батарея Петрова давала напряжение около 1500В. Русский учёный исследовал свойства этой батареи как источника тока и показал, что действие её основано на химических процессах между металлами и электролитом. М. А. Шателен отмечал, что опыты Петрова можно считать исследованиями, положившими начало современной электрометаллургии в дуговых печах. Построенную им батарею Петров использовал для построения электрической дуги. Результаты его работы были подробно изложены в труде «Известия о гальвани-вольтовских опытах», увидевшем свет в 1803 году.
Виды электродов
В состав гальванического элемента входят электроды.
Электроды бывают:
Обратимые электроды
- Электроды 1-го рода — электроды, состоящие из металла, погружённого в раствор его соли;
- Электроды 2-го рода — электрод, состоящий из металла, покрытого труднорастворимой солью этого же металла, погружённый в раствор соли, который содержит общий анион с нерастворимой солью (хлорсеребряный электрод, каломельный электрод, металл-оксидные электроды);
- Электроды 3-го рода — электроды, состоящие из двух нерастворимых осадков электролитов: в менее растворимом есть катион, который образуется из металла электрода, а в более растворимом — есть общий анион с первым осадком;
- Газовые электроды — электроды, состоящие из неактивного металла в растворе и газа (кислородный электрод, водородный электрод);
- Амальгамные электроды — электроды, состоящие из раствора металла в ртути;
- Окислительно-восстановительные электроды — электроды, состоящие из неактивного металла (ферри-ферро-электрод, хингидронный электрод).
Ионоселективные мембранные электроды
- Электроды с ионообменной мембраной с фиксированными зарядами — стеклянный электрод;
- Электроды, состоящие из жидких ассоциированных ионитов;
- Электроды с мембраной на основе мембраноактивных комплексонов;
- Электроды с моно- и поликристаллической мембранами.